大家好,上一篇的文章给大家介绍了➡️医疗器械临床指导原则的学习顺序,同时也帮大家整理了一下各种临床的概念,那么今天,想要跟大家分享一下关于体外诊断试剂临床指导原则的学习。之前的法规很多都是医疗器械和体外诊断试剂在一起的,但是2021年新发布的这几个指导原则,都将体外诊断试剂单独列了出来,所以IVD有自己的特殊性。那么体外诊断试剂和医疗器械临床相比,到底有哪些不一样的地方呢?我们需要怎样注意和区分这些不同的地方,怎样借鉴相同的经验呢?当然了,各位小伙伴估计已经参加过去年审评中心老师的培训了,本文还会带着大家复习加深一下审评老师的关注点,也欢迎各位小伙伴根据自己报证的经验,一起讨论学习哦。好的,话不多说,那就让我们开始今天的分享吧。
”
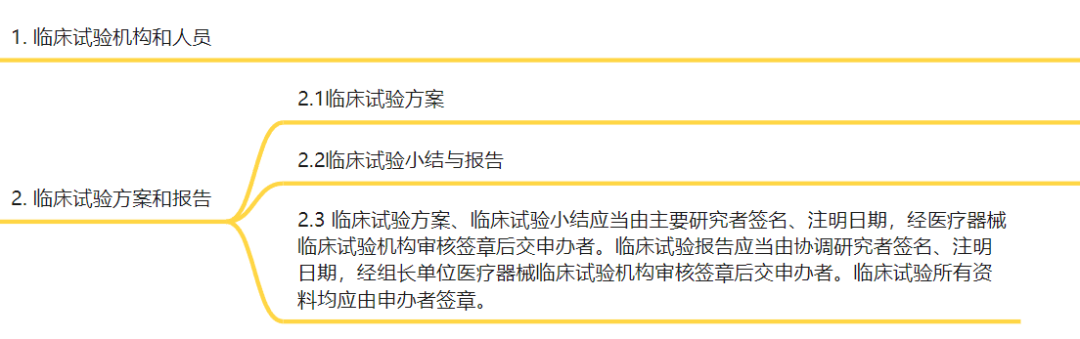
- 01 - 免临床目录的差别 看过之前我介绍医疗器械临床指导原则的小伙伴应该知道,在接到临床项目时,第一步需要考虑的,就是确定我们的项目是否需要进行临床,参考国家局发布的免临床目录。在这里,就出现了医疗器械和IVD的区别。 对于医疗器械来说,之前介绍过,发布的是免临床评价的目录,而不是临床试验,所以之后针对医疗器械还会有决策是否开展医疗器械临床试验技术指导原则。但是到了IVD这里,免临床目录是针对临床试验的,这也决定了之后IVD指导原则的内容。 如果有器械和试剂都在做的小伙伴,一定要注意这个地方的区分哦。 - 02 - 指导原则列举 ➢ 专门针对体外诊断试剂临床的指导原则大概有以下几个: 由于没有了临床评价和临床试验的区分,体外诊断试剂的指导原则学习顺序很好区分,首先是参照免临床试验目录确定是否进行临床,如果在目录里面,那就参考74号令即可,如果不在目录里面,需要进行临床,那么需要按照72号令的内容来进行临床试验的设计,并且严格按照临床质量管理规范进行,完成后,提交临床报告,同时参考91号令,完成数据的递交工作。以上,就是关于体外诊断试剂临床指导原则的学习顺序的介绍。 - 03 - 指导原则的学习思考 通过免临床试验目录可以看出,其实大部分三类的体外诊断试剂还是需要进行临床试验的,仅有几种比较特殊的目标物检测三类试剂可以免于临床试验,所以,我们还是着重的学习一下临床试验技术指导原则的内容和数据递交的内容。参考之前审评中心吕允凤部长的一些讲解,我们一起来看一下吧。 体外诊断试剂临床试验技术指导原则 这篇指导原则大概看了一下,一共是一万三千多个字,非常详细的介绍了IVD临床试验过程中,需要注意的地方,个人认为会更加偏重于科学性,对于临床试验开始前,整体试验设计非常有帮助,针对临床上面流程化的一些东西,还应该结合着临床试验质量管理规范来进行,需要实时的跟进新版的是否发布了,但是,比较内核和原则性的东西,是没有什么变化的。 指导原则内容很多,刚开始看的时候有些无从下手,我们还是现在框架上认识一下。 ➢ 根据这个大的框架,结合培训的内容,给大家把精华和重点来说一下。 1)适用范围 参考这几个变化和不变就可以掌握精髓了哦。 ◇ 不变 体外诊断试剂临床试验的定义 体外诊断试剂临床试验是指在相应的临床环境中,对体外诊断试剂的临床性能进行的系统性研究。 ◇ 增加 体外诊断试剂临床试验的目的 临床试验的目的在于证明体外诊断试剂能够满足预期用途要求,并确定产品的适用人群及适应证。 ◇ 增加 临床性能的定义 体外诊断试剂由预期使用者在预期使用环境中使用,针对目标人群获得与受试者目标状态相关的检测结果的能力。 ◇ 明确 本指导原则的定位 本指导原则旨在明确临床试验的基本原则和临床试验中需要考虑的关键因素 2)基本原则 主要就是这三个方面的内容。 ◇ 伦理原则是大家最为关注的一个地方,我觉得这是因为在临床试验的实际实施过程中,这个部分是大家投入精力和推动项目进展一个非常关键的地方。这里让大家最有疑问的是知情同意的一个变化,其实伦理的基本原则是不变的,只是知情同意的表述变化,仅提及:伦理准则、伦理委员会审查同意、需知情同意;未在提及:免知情的情形、受试者权益高于科学和社会利益、保密、隐私保护。因为这个地方不应该是试剂注册审评的关注点,而应该参考的是国家发布的中华人民共和国人类遗传资源管理条例以及卫建委的一些要求,所以就不在这里重复的进行要求了。 ◇ 依法原则主要包括两个部分,一个是机构和人员的要求,一个是临床方案和报告的要求,变化就是:机构与人员要求的细化、方案和报告形式的变化。 如果大家实在不想看原文的话,可以参考下面我大概整理的一个表格,可能会更加清晰一些。 3)试验设计 这一部分的内容实在是太多了,但都是非常详细关键的哦,下面我选择一些比较关键的和大家进行一个分享,也是抛砖引玉吧,如果大家用到了哪一部分的内容,可以回到指导原则进行细致的学习哦。 主要就是这几个部分的讲解,主要的精华内容包括:(引自审评中心培训) 受试者选择与入组(细化) 样本收集(首次提出) 机构数量、要求、中心效应(科学要求) 临床评价指标(梳理细化) 统计学分析(增加比重),大家可以参考后面高宇老师的培训,一步一步教给大家怎么分析。 样本量要求(重大变化),根据附件的方法进行计算 4)质量管理 这是一个新增的小结,可以看得出来也是对这方面越来越重视了,详细的内容可以等着质量管理规范出来了,这篇指导原则也可以在框架和原则方面有一个很好的参考。 - 04 - 总 结 由于篇幅的关系,今天就给大家分享一下这个试验的指导原则了,由医疗器械和IVD的区别,我们看到了IVD试剂的特殊性,每一个指导原则都值得我们一读再读,反复学习,每次都会有不同的收获。后面也给大家分享一下体外诊断试剂临床试验技术指导原则(2021年第72号)的思维导图吧,还有上面表格图片的Excel版本,大家可以稍微修改一下,就当做一个清单,每次临床试验前,都自己捋一遍,大方向上就不会出错了哦。谢谢大家,有问题我们一起讨论学习。