

2015年,全国卫生产业企业管理协会医学检验产业分会受托对北京、上海、山东、广东、江苏、浙江、江西、福建8个省市51家医疗机构(三级甲等医院24家,二级甲等医院15家,一级医院11家)和一家第三方医学实验室体外诊断试剂使用情况进行了认真深入的调查,通过调查真实地摸清了我国体外诊断试剂的使用情况。
目前中国一级医院只有检验科开展临床检测。二级医院是检验科和病理科。三级医院通常除了检验科和病理科外,尚有多种多样的临床科室附属小实验室在开展临床检测。这些实验室包括核医学科、血液病实验室、风湿免疫科实验室、变态反应免疫实验室、肾内科实验室、生殖中心等。
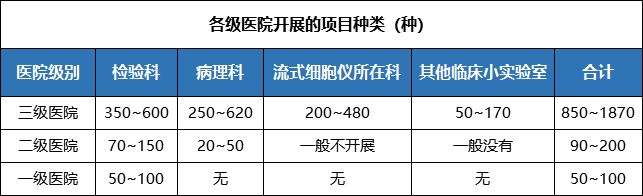
在大型医疗机构活跃使用的体外诊断试剂约1000种左右。综合性三级医院检验科常规使用的体外诊断试剂约500种左右,病理科250~300种,流式细胞仪配套试剂250种左右,各科室特殊试剂几十种。部分特大型医院,如某医院共使用体外诊断试剂近2000种,该医院检验科有600余种,病理科620余种,血液病实验室480余种,各种专科实验室170余种。
二级医院一般开展生化、两对半、三大常规、凝血等几十个检测项目。一级医院开展的检测项目非常有限,通常是生化和三大常规检测。
目前在国内大型三级医院检验科使用的试剂75%左右是进口产品,特别是发光类的肿瘤标志物、性激素、甲状腺激素、血凝、血球等试剂几乎都为进口。目前唯有生化试剂国产比例比较高。一级、二级医院生化试剂几乎全部国产,三级医院也有较高比例的国产试剂。酶标法感染类试剂(比如术前八项)等也全部为国产试剂。
导至进口试剂在大型医院占比如此高的最主要的两个原因是:大型检验设备以进口为主,国内的设备尚未成为主流。除了生化检查外,发光类仪器全部是“封闭系统“,也就是用条码的方法锁定试剂,导至不兼容其他公司的试剂。并且部分行业专家推广“专有封闭试剂质量更好“的理念,助推了进口厂商用仪器占位来控制住耗材供应的情况。另外,大型医院对试剂仪器要求高,认为国产试剂质量不如进口的,故大部分大型医院选择进口的试剂。国内在试剂和仪器的研发水平及产品质量上也还需要更多的专家信任和时间积累。
许多一级医院都是由政府采购平台统一采购,采购渠道比较单一,管理也比较简单,只采购有注册证的产品。二级医院,部分是政府采购平台统一采购和供应,部分为自主采购。
大型三级甲等医院采购的数量1000~2000种,供应商众多。部分医院已经采用了采购及供应商管理的电子化软件系统。供应信息比较完整,管理也比较有序。但很多医院的注册证存档管理情况堪忧,注册证过期或不全等现象普遍。
目前无论三级医院还是一、二级医院,对诊断试剂的物流冷链配送等环节都不够重视。如有用简单塑料袋乘坐地铁送货,没有冰块及基本的泡沫箱保护措施。造成忽视冷链运输的原因也是多种多样。相关检验科人员认为“经验表明”短暂的市内运输没有冷链也不影响试剂质量。另外,体外诊断试剂使用医院订货频次高,单次货物少,用冷链专车运输不现实,这也是普遍反映的问题。在医院接收这个环节,大部分的采购部门人员只关注货物的品种和数量,简单查看一下外观就接收了,对于是否有冷链运输等情况,一般不会关心。
中国第三方检测机构目前已经成为临床检测领域重要的医疗服务机构。根据初步调研,第三方检测机构也有大量使用未注册产品的情况,其主要集中在医院不愿意开展,或医院想规避风险而临床又需要的检测项目,委托外送到第三方检测机构进行检测。主要的种类是现在蓬勃发展的分子检测测序等领域,也包括病理、FISH、流式细胞仪等检查项目。
目前,最主要问题就是大型三级医院使用的体外诊断试剂未注册的品种很多,占比也很高。大型三甲医院使用的1000~2000种试剂中,有注册证的大概占50%~70%。也就是三甲医院中大约有400~700种在使用并出具检验报告和收费的项目相关试剂未经CFDA注册。
在检验科使用的500余种试剂中,绝大部分有注册证。仅少量药敏纸片没有注册证。比如多黏菌素B纸片、伏立康唑纸片、杆菌肽纸片、阿莫西林棒酸纸片等。
活跃使用的400~700种无注册证体外诊断试剂总体上可分为三个大类。包括病理科使用的免疫组化及FISH类试剂、流式细胞仪类试剂、各种专科实验室使用试剂及其他类。
第一大类未注册但在活跃使用的是病理科的免疫组化和FISH等相关试剂。试剂种类大约300种左右,特大型医院有的为600余种。有注册证的免疫组化试剂只有20种左右。也就是90%以上的免疫组化试剂尚未注册但已经在临床广泛使用。这些未注册的产品如:CD15、CD20、CD30、CK7、CK19、CK-H等200~600种。提供这类试剂的供应商主要是国内2家企业和国外2~4家企业。
第二大类未注册但在活跃使用的是流式细胞仪上使用的流式相关试剂。试剂按标志物来区分的种类有200余种。如果按标志物及荧光种类组合来分种类有2000余种,但有注册证的也就20余种。这些流式试剂有的在血液科实验室使用,有的在检验科使用。提供这类试剂的供应商主要是国外4家供应商。
除上述两大类目前临床在使用但未注册的主要试剂外,还有各临床科室下属的专科实验室有很多未经注册的试剂在使用。数量按照医院等级不同在几十到两百种。这些使用试剂的科室主要有自身免疫及变态反应科、生殖中心、肾内科、产前诊断科和血液科等。
根据医院内部查审,无证试剂主要是国外供应商提供。比例大概在50%~95%。国内企业无证试剂的比例明显较低。在无证试剂中,大约有20%的能提供国外原产地的相关认证。绝大部分标示是“仅供科研使用”的试剂。
医疗机构使用未注册试剂,约95%以上的原因是确实找不到已注册的产品但临床医学又比较需要,再加上全国同行都在使用,这样大家也就习以为常使用未注册试剂了。比如病理科中的免疫组化和FISH试剂,流式细胞仪配套试剂等。
极少部分是有注册证的试剂质量不能满足基本需要,只能用未注册试剂。典型的案例是染色体分析时需要的血液细胞培养基,医院反映有注册证的培养基无法培养血细胞,细胞根本不能存活增殖,但进口科研试剂使用效果良好。
另外,进口仪器“专机专用”试剂,导至一旦医院装了这类仪器,部分未注册的试剂也只能使用。否则为了少量检测项目又得添置相应的设备。
极少部分情况是有证试剂奇货可居,价格过于昂贵,与收费不能匹配。在这种情况下,医院也有采购未注册试剂的冲动。
对于未注册试剂的使用从临床医疗本身的必要性和迫切性来看,根据相关医生及医院领导反映这些试剂和项目都是非常必须的。如果停掉将严重影响临床的诊疗活动开展。是否有“为了多收费,临床巧立名目”而开展的过度检测情况,这很难判断。但从总体分析,病理免疫组化试剂大部分涉及实体肿瘤,流式试剂大部分涉及血液肿瘤,免疫组化和流式项目收费大约每个项目40~60元。如果平均每人做5个指标,大约花费200~300元。在医院一个肿瘤病人医疗费用动辄几万几十万的背景下,再冒风险故意使用未注册试剂多收几百元的冲动不大。故推断总体上至少医疗机构使用未注册试剂的出发点还是自己认为临床确有开展这些项目的必要性。
一些大型三甲医院,某些专科在全国和国际上都有较高知名度,其专业的发展部分有赖于最新的或最为特殊的专业诊断试剂。他们都反映如果完全不准使用未注册的诊断试剂,他们的学科发展将无法保证,全国各地来的病人也得不到区别于其他医院的诊治。
为何国家食品药品监督管理总局已经颁布了相关的法规,地方食品药品监督管理部门也对医疗机构经常有检查和处罚的情况下,仍然有50%左右的诊断试剂没有注册证呢?原因主要有如下三个方面。
(一)单个试剂销量很少但种类繁多,注册相关费用无法承受
比如免疫组织化学有300~600种试剂,流式抗体类有200种(如果按荧光素分有2000种)试剂。单个的年销量也就几十万至200万之间。利润也就几万至几十万左右。根据目前法规,这些试剂都属于三类。如果全部去注册,估计每个试剂需要50万的相关费用,300种就需要1.5亿元的注册费用。这个天文数字企业是无法承担的。再加上大家都没证,反正法不责众,就造成了如今90%以上病理和流式试剂未注册。
(二)单个品种试剂用量很少,市场价值很低
某些领域,种类虽然不多,但单个品种试剂用量很少,市场价值很低。对这类试剂企业也没有注册的动力。比如对某些稀有血型的鉴定试剂,某些罕见疾病的检验试剂。又比如药敏纸片,单价很低,虽有需求,但企业不愿注册。
(三)某些新方法新技术用于临床诊断
某些领域医学基础研究发展很快,部分重大的医学热点国外已经采用了某些新方法新技术用于临床诊断。国内临床医生也想尽快开展起来,但企业研发产品及注册需要较长时间。比如之前的无创产前筛查项目,在肿瘤领域比如循环肿瘤细胞试剂、循环肿瘤游离核酸检测试剂,个性化用药相关试剂等。
企业反映的问题主要集中在如下几个方面。
(一)体外诊断试剂部分品种分类不尽合理
比如无证试剂的重灾区流式试剂和病理免疫组化试剂按目前分类都属于三类。这造成临床验证周期和注册费用大幅度上升。但实际上,这类试剂在诊疗过程中属于“辅助”性质,不属于“确诊”性质。能否把这类试剂降低类别至二类?
(二)针对流式试剂,每个靶标有多种荧光素的标记
针对流式试剂,每个靶标有多种荧光素的标记。200种靶标每个几乎都有10种标记。按照现有法规,每种标记都是一种试剂,那流式试剂就有2000个品种。全部报批至少5个亿以上的费用,这显然不现实。能否按照靶标进行归类,不同标记作为规格,这样就能节约部分注册的费用。
(三)某些审批备案环节没有必要
企业普遍反映,目前食品药品监督管理药部门审批的流程还是太长,某些审批备案环节没有必要。比如临床验证要备案、拿到注册后再等45个工作日才能拿到生产许可证变更等等,这些环节完全没有必要。
(四)注册收费标准过高
关于新出台的医疗器械注册收费的规定,企业普遍反映,针对体外诊断试剂品种多,单个试剂价值低的特点,目前注册收费标准还是太高。不能把体外诊断试剂等同于CT、核磁共振等大型医疗设备,笼统归到医疗器械统一一个注册收费标准。因为大型设备品种很少,一家生产企业也就研发申报几种或几十种。但体外诊断试剂生产厂家需要报批注册的品种很多,通常有几百种。但目前收费规定的出台和实施,肯定将迅速加剧企业负担,将导至类似免疫组化试剂、流式试剂的供应商更无力承担注册费用。
(五)适用法规要一视同仁
有企业提出,针对国内外试剂供应商,适用法规要一视同仁。有的临床医生提出,是否产品在国外有注册证,在国内就可以允许使用?这个超国民待遇是不平等的,国内企业表示反对。
对于已经注册的产品,要加强上市后的监管。要加强生产企业和医院使用端的质量抽验。要注意流通物流领域的冷链运输等环节的规范,制定出合乎实际情况的规章和细则。另外,要对各省市的审批标准统一化,防止个别地方政府为了招商引资,对劣质产品“放水”。
对于如此众多的未经注册但已经广泛使用的体外诊断试剂,如何监管是个难题。既不能放任不管,导至良莠不齐的未注册产品借机公然使用;但也不能机械地“管死”,导至阻碍创新科技成果的临床应用。专家建议,对于大型医疗机构中部分临床领先、或具备优势、特色的学科,为了保持学科的发展和医学的创新,在市场上没有有证产品供给的情况下,能否采用国际上常用实验室自建方法的模式或院内制剂的管理办法进行管理。这样即能保证安全有效,也可进行规范管理,同时又不阻碍创新和学科发展。
如果现存的无证试剂仍然按照体外诊断试剂法规监管,能否对目前两大类主要无证试剂领域即病理免疫组化试剂和流式试剂降低分类的类别,从目前三类改成二类,并且对“老大难”类试剂临时降低注册费用,鼓励企业尽快注册。事实上仅对病理组织的分化、组织来源、某些癌基因抑癌基因表达的指标是辅助病理医生形态学的诊断,主要是给病理医生提供参考信息的,其风险不大,建议对大部分免疫组化试剂和流式试剂放松管制,改成二类。
对于罕见病相关检测试剂和用量特别少或价值特别低的试剂,能否出台按照实际情况大幅降低临床病例要求、降低注册报批的费用等措施。比如稀有血型鉴定试剂、药敏纸片试剂等。
在体外诊断试剂监管活动中,希望能更多地发挥和吸收各种专业学会、协会和专家的力量,来辅助食品药品监督管理部门共同规范好体外诊断试剂的生产流通、临床使用及质量控制。建立合理科学及易研判的体外诊断试剂分类规则。

说明:“牢记历史,不忘初衷”,本文摘自《中国体外诊断产业发展蓝皮书》(2017年·第三卷)。“以史为镜,可以知兴替”,《中国体外诊断产业发展蓝皮书》是行业权威发布且按年度连续出版的大型品牌馆藏图书,内容涵盖全面,从各个角度客观、公开地记录和见证了过去体外诊断产业人的努力、创新和成就,是中国体外诊断产业、医学检验及广大医药卫生工作者必备的工具书,为行业发展态势留下文字依据,给未来耕耘者留下纪念和指引,也是引导IVD行业的风向标。