

来源:本文刊登于《中国医疗器械信息》杂志2019年第13期
作者:刘倩瑜 吴静标*
单位:广东省医疗器械质量监督检验所 (广东 广州 510663)
内容提要:分子诊断领域是目前体外诊断行业新兴活跃的领域之一。文章对现有的分子诊断领域试剂产品标准进行统计分析,发现该领域的试剂产品品种多样,行业标准的制修订在逐步完善,但相关的行业标准较少,影响了该领域的发展。 关 键 词:分子诊断 标准 比较
分子诊断是指应用分子生物学方法检测患者体外遗传物质的结构和表达水平的变化而做出的诊断技术。分子诊断主要应用于感染性疾病、遗传病、肿瘤和药物基因组学检测四个方面。分子诊断领域包含的产品主要有荧光PCR检测试剂盒产品、荧光原位杂交检测试剂盒、基因测序产品、基因芯片产品等,绝大部分按Ⅲ类产品进行管理。目前,国内提供试剂盒和仪器产品以及提供分子诊断检测服务的公司很多,而研发、生产原材料和高端仪器的公司很少,市面上分子诊断试剂盒产品多样,质量也是参差不齐,相关的行业标准较少,严重影响了该领域的发展。
1.分子诊断领域试剂产品国家行业标准现状
体外诊断试剂的国家标准、行业标准在体外诊断试剂产品生产、监管中起着举足轻重的作用,标准是一把尺子,是产品质量保证的基础。近年来,分子诊断领域试剂产品的行业标准数量和质量均有所提高,截止至2019年4月,分子诊断领域试剂产品的国家行业标准达19项,均为行业推荐性标准,其中18项为产品相关标准,1项为基础通用标准。分子诊断领域试剂产品国家行业标准详细信息见表1。
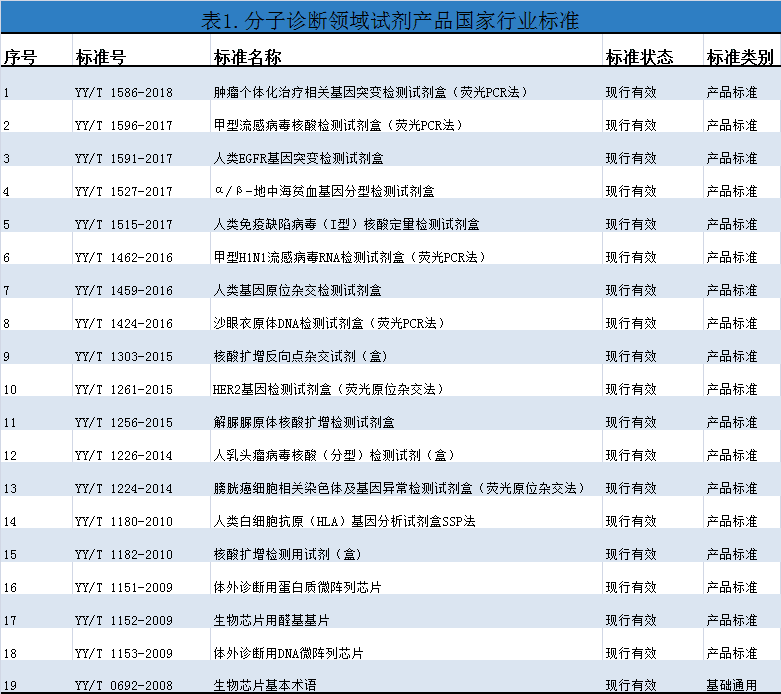
2.分子诊断领域试剂产品国家行业标准的分析
目前现行有效的19项分子诊断领域试剂产品国家行业标准主要涵盖的方法学有基因芯片法、荧光PCR法、荧光原位杂交法。以下仅针对三个方法学的产品进行比较分析。
2.1基因芯片法
适用于基因芯片法的行标主要为YY/T 1151-2009《体外诊断用蛋白质微阵列芯片》、YY/T 1153-2009《体外诊断用DNA微阵列芯片》、YY/T 1226-2014《人乳头瘤病毒核酸(分型)检测试剂(盒)》(4.2项)等。YY/T 1151-2009、YY/T 1153-2009这两个2009年发布的两个行业推荐性标准对于基因芯片法产品的质量控制常检测以下几个项目:物理性能(外观、点重复、点性状、质控设置)、最低检测限、阳性符合率、阴性符合率、批内重复性、稳定性。其中,蛋白质微阵列芯片的重复性项目检测用样品浓度应为试剂最低检测限3~5倍,而DNA微阵列芯片的重复性项目检测用样品浓度应比最低检测限值高1个数量级。近几年发布的标准,基因芯片技术产品的质量控制指标与其他方法学的更相似,只是部分项目的判定要求有所差异,如重复性指标,荧光PCR法的判定要求为判定Ct值的变异系数,而基因芯片法的判定要求为各阵列位点检测结果应一致等。
2.2荧光PCR法
适用于荧光PCR法的行标主要为YY/T 1226-2014《人乳头瘤病毒核酸(分型)检测试剂(盒)》(4.1项)、YY/T 1256-2015《解脲脲原体核酸扩增检测试剂盒》、YY/T 1424-2016《沙眼衣原体DNA检测试剂盒(荧光PCR法)》、YY/T 1462-2016《甲型H1N1流感病毒RNA检测试剂盒(荧光PCR
法)》、YY/T 1591-2017《人类EGFR基因突变检测试剂盒》、YY/T 1586-2018《肿瘤个体化治疗相关基因突变检测试剂盒(荧光PCR法)》等。总结这几年涉及荧光PCR法的行业推荐性标准不难发现,对于荧光PCR法产品的质量控制主要检测以下几个项目:外观、准确性(阳性符合率)、特异性(阴性符合率)、重复性(精密度)、检测限(检出限、最低检测限)、核酸提取效率、稳定性等,个别具有不同基因分型的产品需要进行基因分型检测。荧光PCR方法产品较为多样化,常见产品可以测试多种基因分型,为合理科学判定产品的质量,检测项目在选用检测样本时应考虑分型的因素,如YY/T 1226-2014规定重复性至少用两种不同型别国家分型参考品或经标化的企业参考品进行检测,YY/T 1527-2017规定重复性样品α-非缺失型地中海贫血基因型不少于2个、α-缺失型地中海贫血基因型不少于3个、β-地中海贫血基因型不少于5个等。并且,在最新发布的三项标准YY/T 1591-2017(2017-12-05发布)、YY/T 1596-2017(2017-12-05发布)、YY/T 1586-2018(2018-02-24发布)对各项重要指标的参考品设置均提出了要求,这一项变化更有利于规范不同检测机构、企业在对产品质量检测,有助于增加检测结果的一致性和互通性,统一对产品的质量评价。
2.3荧光原位杂交法
适用于荧光原位杂交法的行标主要为YY/T 1224-2014《膀胱癌细胞相关染色体及基因异常检测试剂盒(荧光原位杂交法)》、YY/T 1261-2015《HER2基因检测试剂盒(荧光原位杂交法)》、YY/T 1459-2016《人类基因原位杂交检测试剂盒》等。对于荧光原位杂交法产品的质量控制主要检测以下几个项目:外观、信号强度、探针质量判断(探针敏感性、探针特异性)、探针有效性判断(阳性符合率、阴性符合率)、稳定性。由于荧光原位杂交法产品特异性较强,各项标准的指标判定要求、样本选择均根据产品而定,在探针有效性判断上,YY/T 1224-2014、YY/T 1261-2015两份标准要求检测至少4例临床样本制片,YY/T 1459-2016则要求至少5例。
3.总结
分子诊断领域被认为是体外诊断行业目前研发最活跃的领域,分子诊断领域试剂产品种类繁多,产品在日益发展,标准相对滞后,为了满足行业监管需要,我国应加快分子诊断领域国家标准及行业标准制修订工作。分子诊断领域试剂产品的标准制修订,有利于各大检测机构、企业统一适用性认识,统一检测尺度,对产品更好的把关,更好地规范分子诊断领域发展。