

全国临检会、中国临床检验设备及用品展会、检验耗材展会、诊断试剂展会、中国检验医学及输血用品博览会、诊断试剂展会、检验耗材展会、检验会、临检设备展会、临检会、ceep临检会、全国临床检验展览会,全国临床检验展览会 检验耗材展、诊断试剂展、临床检验设备展会、临床检验医学展会、上海临检会、诊断试剂展会、临床检验展会、上海临检验展会、上海临检验展、体外诊断试剂展、年体外诊断试剂会、体外诊断试剂会、体外诊断试剂大会
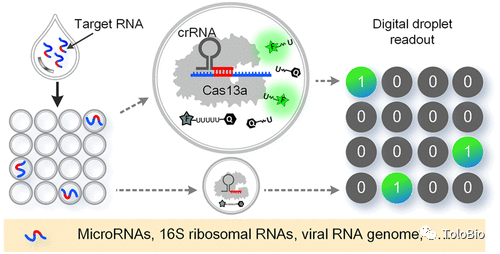
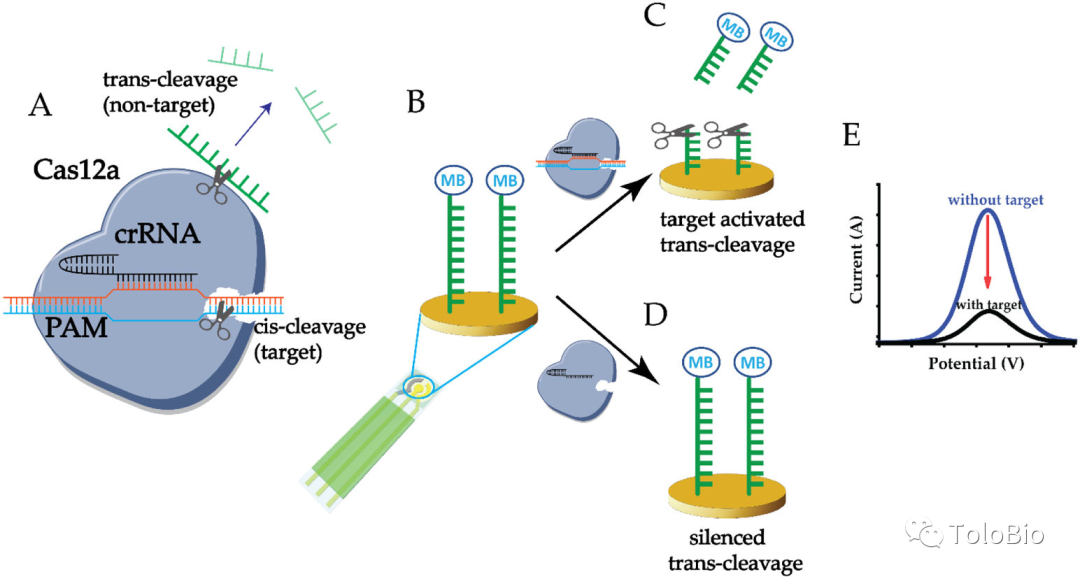
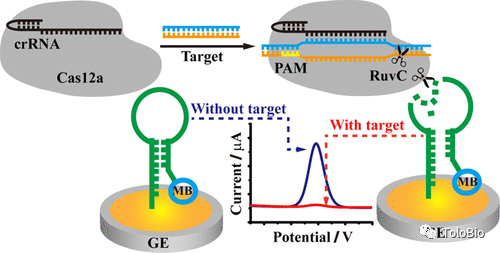
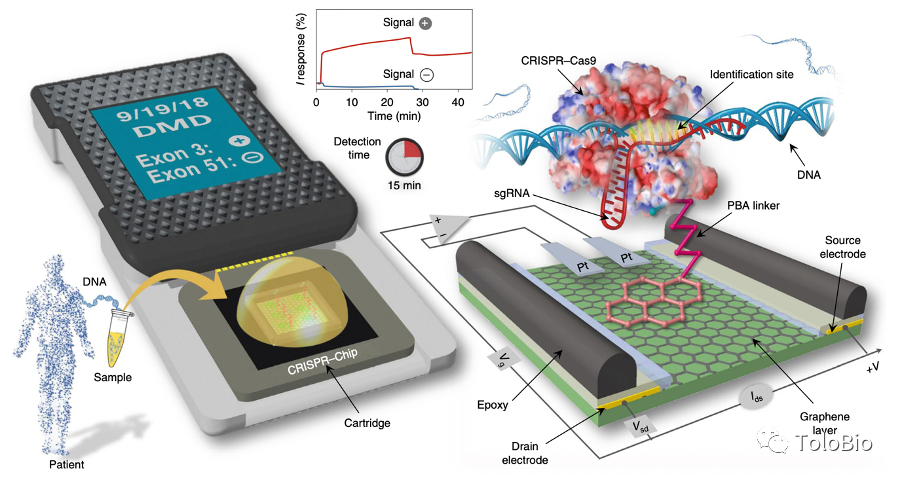
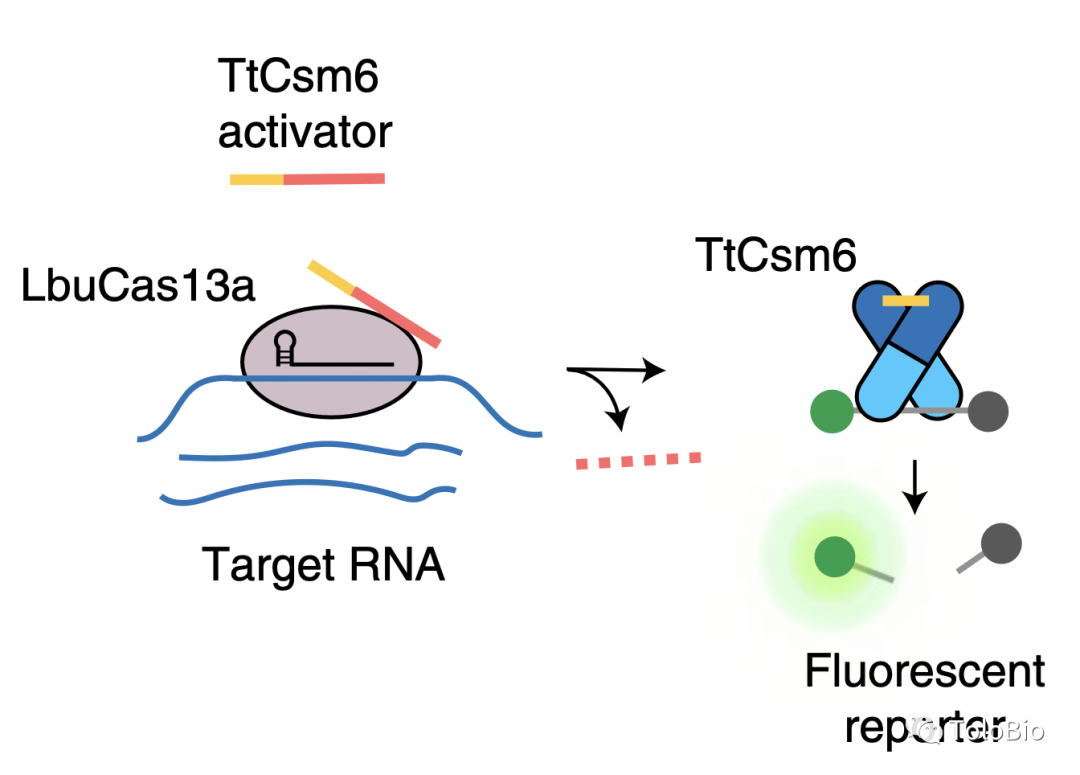
图5. Cas13a和Csm6 RNA内切酶联合使用的级联放大策略原理[17]
[1] Zhang J., Lv H., Li L., Chen M., Gu D., Wang J., et al (2021). Recent Improvements in CRISPR- Based Amplification-Free Pathogen Detection. Front. Microbiol. 12:751408.
[2] Tian, T., Shu, B., Jiang, Y., Ye, M., Liu, L., Guo, Z., et al. (2021). An ultralocalized Cas13a assay enables universal and nucleic acid amplification-free single-molecule RNA diagnostics. ACS Nano 15(1), 1167-1178.
[3] Yue, H., Shu, B., Tian, T., Xiong, E., Huang, M., Zhu, D., et al. (2021). Droplet Cas12a assay enables DNA quantification from unamplified samples at the single-molecule level. Nano Lett 21(11), 4643-4653.
[4] Shinoda, H., Taguchi, Y., Nakagawa, R., Makino, A., Okazaki, S., Nakano, M., et al. (2021). Amplification-free RNA detection with CRISPR-Cas13. Commun Biol 4(1), 476.
[5] Dai, Y., Somoza, R.A., Wang, L., Welter, J.F., Li, Y., Caplan, A.I., et al. (2019). Exploring the trans-cleavage activity of CRISPR-Cas12a (cpf1) for the development of a universal electrochemical biosensor. Angew Chem Int Edit 58(48), 17399-17405.
[6] Lee, Y., Choi, J., Han, H.K., Park, S., Park, S.Y., Park, C., et al. (2021). Fabrication of ultrasensitive electrochemical biosensor for dengue fever viral RNA Based on CRISPR/Cpf1 reaction. Sensor Actuat B-Chem 326, 128677.
[7] Zhang, D., Yan, Y., Que, H., Yang, T., Cheng, X., Ding, S., et al. (2020). CRISPR/Cas12a-mediated interfacial cleaving of hairpin DNA reporter for electrochemical nucleic acid sensing. ACS Sensors 5(2), 557-562.
[8] Sheng, Y., Zhang, T., Zhang, S., Johnston, M., Zheng, X., Shan, Y., et al. (2021). A CRISPR/Cas13a-powered catalytic electrochemical biosensor for successive and highly sensitive RNA diagnostics. Biosens Bioelectron 178.
[9] Nouri, R., Jiang, Y., Lian, X.L., and Guan, W. (2020). Sequence-specific recognition of HIV-1 DNA with solid-state CRISPR-Cas12a-assisted nanopores (SCAN). ACS Sensors 5(5), 1273-1280.
[10] Bruch, R., Baaske, J., Chatelle, C., Meirich, M., Madlener, S., Weber, W., et al. (2019). CRISPR/Cas13a-powered electrochemical microfluidic biosensor for nucleic acid amplification-free mirna diagnostics. Adv Mater 31(51), e1905311.
[11] Bruch, R., Johnston, M., Kling, A., Mattmuller, T., Baaske, J., Partel, S., et al. (2021). CRISPR-powered electrochemical microfluidic multiplexed biosensor for target amplification-free miRNA diagnostics. Biosens Bioelectron 177, 112887.
[12] Xu, W., Jin, T., Dai, Y., and Liu, C. (2020). Surpassing the detection limit and accuracy of the electrochemical DNA sensor through the application of CRISPR Cas systems. Biosens Bioelectron 155,112011.
[13] Hajian, R., Balderston, S., Tran, T., deBoer, T., Etienne, J., Sandhu, M., et al. (2019). Detection of unamplified target genes via CRISPR–Cas9 immobilized on a graphene field-effect transistor. Nat Biomed Eng 3(6), 427-437.
[14] Balderston, S., Taulbee, J.J., Celaya, E., Fung, K., Jiao, A., Smith, K., et al. (2021). Discrimination of single-point mutations in unamplified genomic DNA via Cas9 immobilized on a graphene field-effect transistor. Nat Biomed Eng 5, 713-725.
[15] Guk, K., Keem, J.O., Hwang, S.G., Kim, H., Kang, T., Lim, E.K., et al. (2017). A facile, rapid and sensitive detection of MRSA using a CRISPR-mediated DNA FISH method, antibody-like dCas9/sgRNA complex. Biosens Bioelectron 95, 67-71.
[16] Sha, Y., Huang, R., Huang, M., Yue, H., Shan, Y., Hu, J., et al. (2021). Cascade CRISPR/cas enables amplification-free microRNA sensing with fM-sensitivity and single-base-specificity. Chem Commun 57(2), 247-250.
[17] Gootenberg, J.S., Abudayyeh, O.O., Kellner, M.J., Joung, J., Collins, J.J., and Zhang, F. (2018). Multiplexed and portable nucleic acid detection platform with Cas13, Cas12a, and Csm6. Science 360(6387), 439-444.
[18] Shi, K., Xie, S., Tian, R., Wang, S., Lu, Q., Gao, D., et al. (2021). A CRISPR-Cas autocatalysis-driven feedback amplification network for supersensitive DNA diagnostics. Sci Adv 7(5), eabc7802.
[19] Fozouni, P., Son, S., Diaz de Leon Derby, M., Knott, G.J., Gray, C.N., D'Ambrosio, M.V., et al. (2021). Amplification-free detection of SARS-CoV-2 with CRISPR-Cas13a and mobile phone microscopy. Cell 184(2), 323-333.
[20] Choi, J.H., Lim, J., Shin, M., Paek, S.H., and Choi, J.W. (2021). CRISPR-Cas12a-based nucleic acid amplification-free dna biosensor via au nanoparticle-assisted metal-enhanced fluorescence and colorimetric analysis. Nano Lett 21(1), 693-699.
[21] Zhou, T., Huang, R., Huang, M., Shen, J., Shan, Y., and Xing, D. (2020). CRISPR/Cas13a powered portable electrochemiluminescence chip for ultrasensitive and specific MiRNA detection. Adv Sci 7(13), 1903661.