在设计临床试验时,应将产品预期用途、检测结果的性质(定性或定量等)以及临床参考标准和参比试剂的可获得性等因素合并在一起进行综合考虑,临床试验结论应能够支持预期用途描述的内容。临床试验方案中应针对临床参考标准或参比试剂的选择及依据进行明确描述。
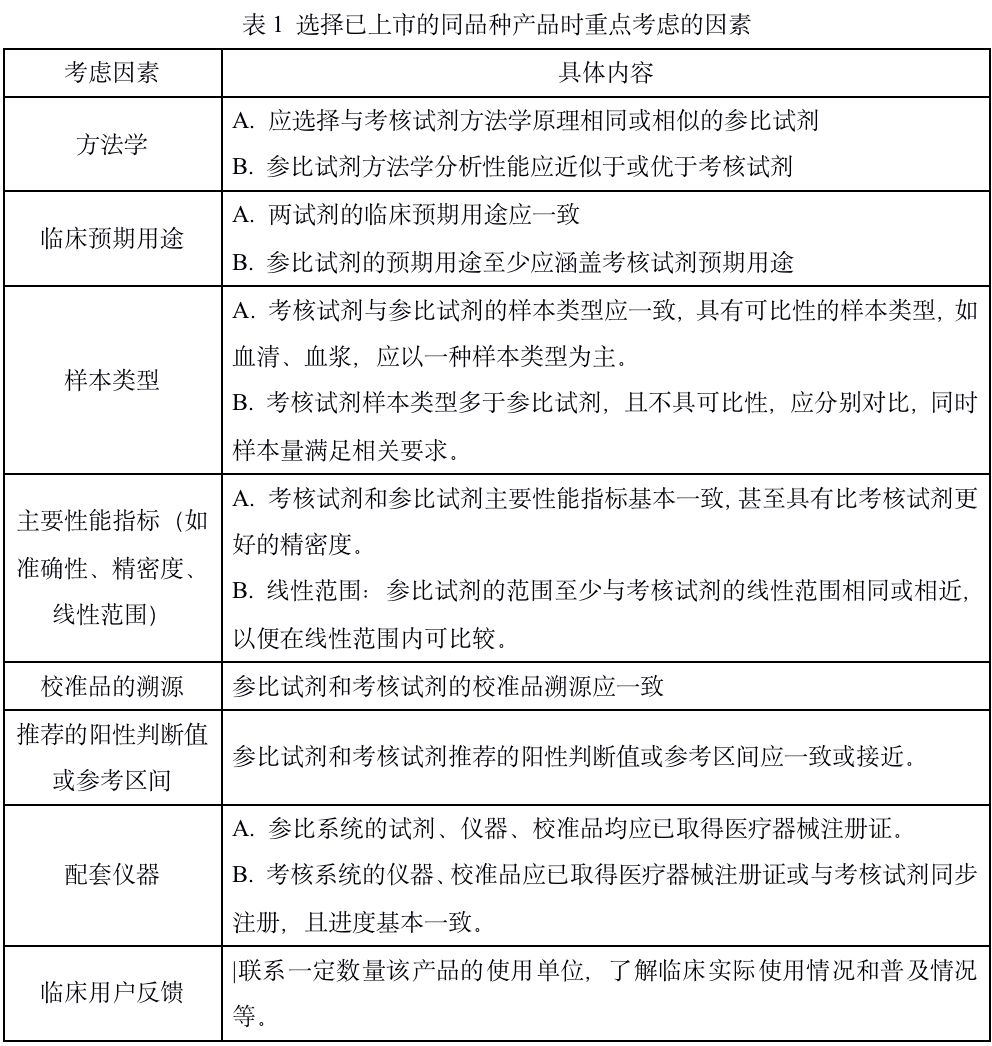
一、“已有同品种批准上市”产品临床试验 对于已有同品种产品上市的体外诊断试剂,考核试剂与已上市同品种产品(参比试剂)对同一组临床样本进行检测,对结果进行比较研究,证明两者等效,从而间接证明考核试剂临床性能满足预期用途的要求。参比试剂在预期用途、适用人群、样本类型、检测性能等方面应与考核试剂具有较好的可比性。 选择目前临床普遍认为质量较好的产品作为参比试剂,同时应充分了解所选择产品的技术信息,包括方法学、临床预期用途、样本类型、主要性能指标(如准确性、精密度、线性范围等),校准品的溯源情况、推荐的阳性判断值或参考区司等,以便对试验结果进行科学的分析。在选择参比试剂时应重点考虑的因素如下表所示。 为了更加全面地评价体外诊断试剂的临床性能,临床试验中亦可将与临床参考标准的比较研究和与已上市同类产品的比较研究相结合,对产品的预期用途和被测物检测准确性等性能进行综合评价。 二、新研制体外诊断试剂的临床试验 一般情形下,新研制体外诊断试剂的临床试验应采用考核试剂诊断性能与临床参考标准进行比较研究的方法,评价考核试剂的临床诊敏感性和特异性,从而证明其临床诊断性能满足预期用途的要求。临床参考标是指现有条件下临床上可获得的能够用来确定受试者目标状态(健康状态病状态、疾病进程、指导临床处置的疾病或健康状态等)的最佳方法,通常自临床和实验室的医学实践,包括现有条件下公认的、可靠的、权威的疾病断标准(如组织病理学检查、影像学检查、病原体分离培养鉴定、长期随访得的结论等),疾病诊疗指南中明确的疾病诊断方法,行业内的专家共识或临上公认的、合理的参考方法等。临床参考标准可能是一种方法,也可能是多方法相结合。 对于某些目前临床上尚不存在明确的临床参考标准、亦无同类产品上市的情况,临床试验研究者应依据现有临床实践和理论基础,建立目前公认、合理的方法进行比较研究。另外,对于风险较高的产品,建议优先选择与临床参考标准进行比较研究。对用于早期诊断、疗效监测、预后判断等用途的体外诊断试剂,在与临床参考标准进行比较研究的同时,还必须对受试者进行跟踪研究。研究者应明确受试者的人选标准、随访标准和随访时间。 三、变更申请中涉及的产品临床试验 体外诊断试剂变更注册的临床试验一般采用变更后产品与变更前产品进行格测性能比较研究;对于变更前后产品性能发生显著变化的或增加临床适应证等情形,亦可采用对其临床诊断性能与临床参考标准或已上市同类产品的临床诊断性能进行比较研究的方法,证明变更后产品的临床性能。 四、其他特殊情形的临床试验 对于某些体外诊断试剂,临床试验中可能遇到需要特殊考虑的情形,例如: ◎由消费者个人自行使用的体外诊断试剂,临床试验中除需评价检测试剂临床性能以外,还需评价无医学背景使用者对产品说明书的认知能力,并证明无医学背景使用者与专业检验人员检测结果的一致性。 ◎与指导用药相关的产品的临床试验,除需进行被测物检测准确性评价以外,还需评价检测结果对临床用药和患者管理的指导效果,以证明检测试剂可以使患者临床获益。 ◎用于疗效监测、预测、预后判断等用途的体外诊断试剂的临床试验,应对受试者进行多个时间点的重复观测(随访),以证明其预期用途和适用人群等。研究者应根据疾病病程明确受试者随访时间、评价指标等。 ◎疾病筛查类产品(如用于胎儿染色体非整倍体疾病产前筛查的检测试剂等)应进行前瞻性的临床试验,针对筛查人群纳入受试者,以相关疾病的临床诊断标准(包括受试者随访结果)为对照,证明产品的灵敏度、特异性、阳性阴性预期值、似然比、相对风险值等临床性能指标满足要求。 ◎某些情况下,试验用体外诊断试剂与参比试剂由于标本采集、处理、保存等差异,导至不能使用同一份标本进行检测(例如,适用标本为拭子标本,但两种方法适用的拭子材质和保存液不同的情况),此时可针对每位受试者分别采集标本并进行试验用试剂和参比试剂的检测,两次采集标本的顺序应遵循随机原则。需要注意的是,一般仅在一次标本采集不会影响下一次标本采集时才考虑采用此种试验方法