免疫学的发展史起始于微生物学研究,于18世纪建立,19世纪至20世纪中期进入经典发展期。这一时期,人们对免疫功能的认识由人体现象的观察进入了科学实验时期。
20世纪初期到中期,进入近代免疫学时期。从20世纪中期开始,真正进入现代免疫学时期。现代免疫学的检测基本历经了以下几个过程。
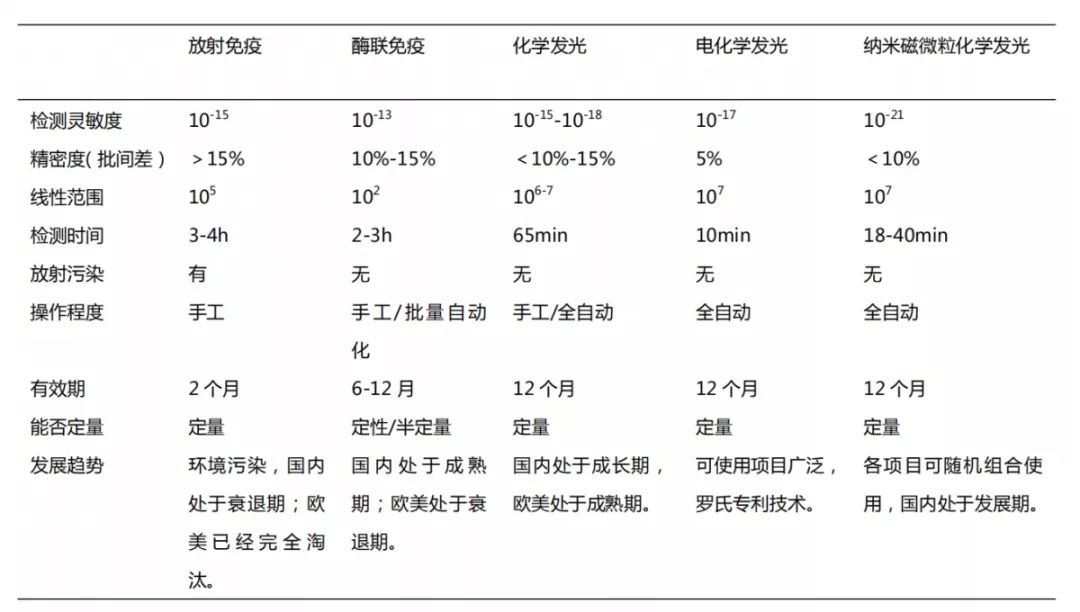
1960年前后 第一代免疫技术 放射免疫技术:利用放射性同位素作为标记物测量抗原抗体结合。 1970年前后 第二代免疫技术 酶联免疫技术:利用活性酶作为标记物的酶联免疫 1980年前后 第三代免疫技术 板式化学发光:非均相,微孔板,板界面反应,化学发光免疫技术 1990年至今 第四代免疫技术 纳米磁微粒管式化学发光:均相,管式,在溶液中反应,化学发光免疫技术 利用抗原和抗体的特异性反应进行检测,利用同位素、酶、化学发光物质等对检测信号进行放大和显示,常被用于检测蛋白质、激素等微量物质。免疫诊断在临床诊断中占据着非常重要的地位,常见的免疫技术有放射性免疫、酶联免疫、化学发光、电化学发光、纳米磁微粒化学发光。
使放射性标记抗原和未标记抗原(待测物)与不足量的特异性抗体竞争性地结合,反应后分离并测量放射性而求得未标记抗原的量。用反应式表示为: *Ag为同位素标记的抗原,与未标记的抗原Ag有相同的免疫活性,两者以竞争性的方式与抗体Ab结合,形成*Ag-Ab或Ag-Ab复合物,在一定反应时间后达到动态平衡。
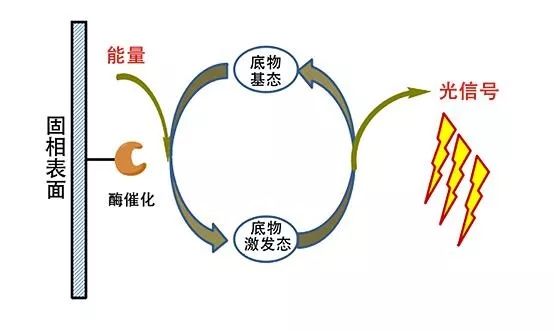
简称ELISA法,它的中心就是让抗体与酶复合物结合,然后通过显色来检测。 使抗原或抗体结合到某种固相载体表面,并保持其免疫活性。使抗原或抗体与某种酶连接成酶标抗原或抗体,这种酶标抗原或抗体既保留其免疫活性,又保留酶的活性。 在测定时,把受检标本(测定其中的抗体或抗原)和酶标抗原或抗体按不同的步骤与固相载体表面的抗原或抗体起反应。 用洗涤的方法使固相载体上形成的抗原抗体复合物与其他物质分开,最后结合在固相载体上的酶量与标本中受检物质的量成一定的比例。加入酶反应的底物后,底物被酶催化变为有色产物,产物的量与标本中受检物质的量直接相关,故可根据颜色反应的深浅来进行定性或定量分析。 由于酶的催化频率很高,故可极大地放大反应效果,从而使测定方法达到很高的敏感度,ELISA可用于测定抗原,也可用于测定抗体。 化学发光免疫分析(CLIA)是一种高度敏感的微量测定技术,凡具有抗原性的物质(包括半抗原)都可以用CLIA测定。CLIA起步于80年代初,快速发展于90年代。
利用化学反应释放的自由能激发中间体(常用碱性磷酸酶-金刚烷胺、辣根过氧化酶-鲁米诺衍生物、辣根过氧化酶-鲁米诺衍生物),使其从激发态回到基态。当中间体从激发态回到基态时会释放等能级的光子,对光子进行测定而进行定量分析。 化学发光具有荧光的特异性,同时不需要激发光,避免了荧光分析中激发光杂散光的影响从而提高了灵敏度,并且避免了放射分析造成的环境污染和健康危害,是一种非常优秀的定量分析方法。 化学发光免疫分析(CLIA)是一种高度敏感的微量测定技术,凡具有抗原性的物质(包括半抗原)都可以用CLIA测定。CLIA起步于80年代初,快速发展于90年代。
电化学发光(ECL)是电场参与化学发光所产生的结果,是指通过施加一定的电压进行电化学反应:体系中电极表面的三丙胺TPA释放电子,进而释放质子成为自由基TPA*,同时,二价的三联吡啶钌[Ru(bpy)3]2+ 释放电子成为三价的三联吡啶钌 [Ru(bpy)3]3+。 具有强氧化性的三价的三联吡啶钌 [Ru(bpy)3]3+ 和具有强还原性的三丙胺自由基 TPA*发生氧化还原反应,结果使三价的三联吡啶钌 [Ru(bpy)3]3+ 还原成激发态的二价的三联吡啶钌[Ru(bpy)3]2+,激发态 [Ru(bpy)3]2+衰变并以释放出波长为 620nm 光子的方式释放能量,而成为基态的 [Ru(bpy)3]2+。 上述化学发光过程后,反应体系中仍存在二价的三联吡啶钌 [Ru(bpy)3]2+ 和三丙胺TPA,使得电极表面的电化学反应过程可以继续进行。这样,整个反应过程可以不断循环,测定信号不断放大,从而使检测灵敏度大大提高,所以 ECL 测定具有高灵敏的特点。
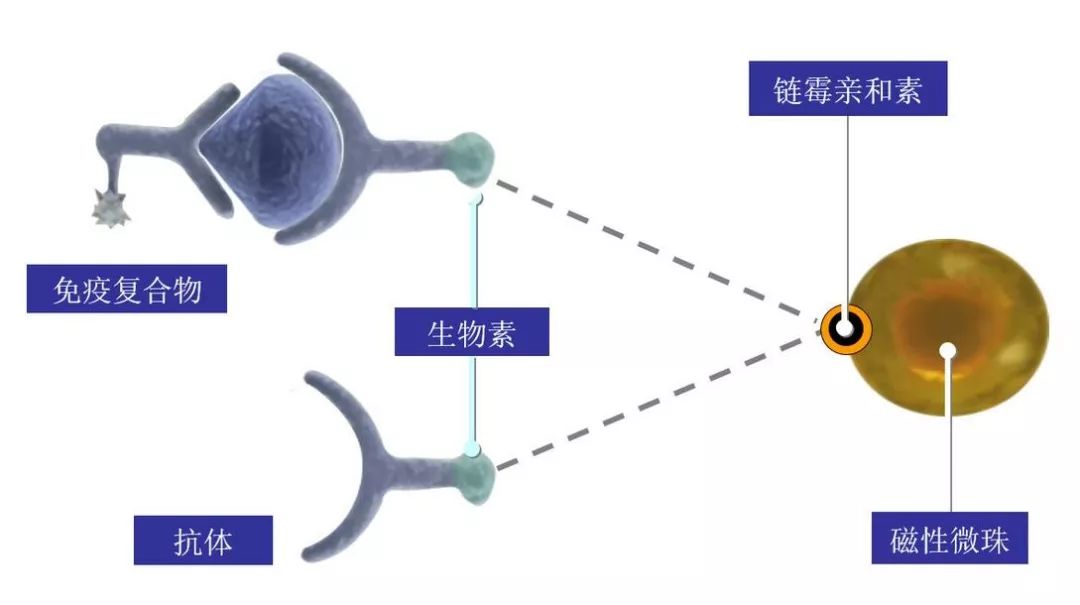
是将磁性分离技术、化学发光技术、免疫分析技术三者结合起来的一种新兴分析方法,该技术充分利用了磁性分离技术的快速易自动化性,化学发光技术的高灵敏度性,以及免疫分析的特异性,在生物分析领域展现了不可替代的作用。 目前,磁微粒化学分析免疫分析已经应用于管式化学发光免疫检测项目以及电化学发光免疫检测项目。
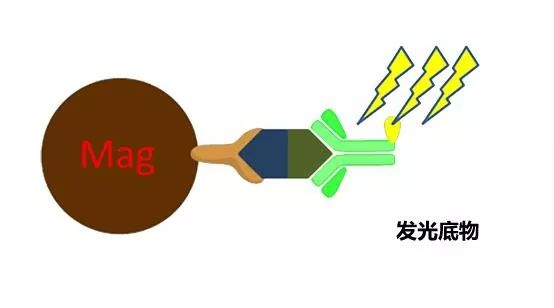
间接法 间接法就是包被抗原,然后用酶标记的抗抗体检测样本中抗体,适合于检测对象是自身抗体的情况。 优点:相对较方便,只要变换包被抗原就可以检测不同的项目。 缺点:标本中的特异性抗体会竞争性的结合抗原,使结果出现假阴性。
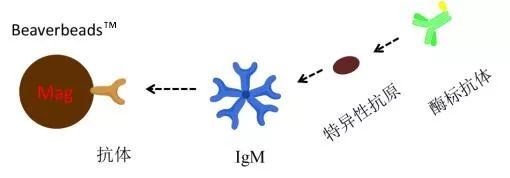
捕获法 血清中针对某些抗原的特异性IgM常和特异性IgG同时存在,后者会干扰IgM抗体的测定,因此测定IgM抗体多用捕获法。 原理如下图,先将所有血清IgM(包括异性IgM和非特异性IgM)固定在固相上,去除IgG后测定特异性IgM。
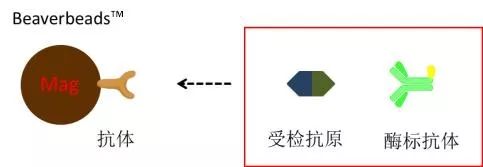
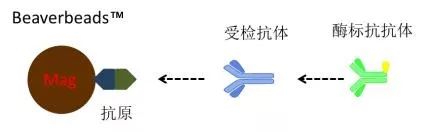
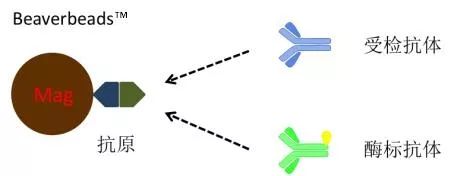
固相抗原竞争法 指受检抗体和酶标抗体竞争性的与磁珠表面抗原结合。固相抗原竞争法基本原理如下图所示。结合于固相载体的酶标抗体与受检抗体的量呈反比。 若受检样本中无抗体,酶标抗体能够顺利与抗原结合,出现强信号。若受检样本中有抗体,则竞争性的占去了酶标抗体与抗原的结合,酶标抗体的结合力减弱,信号强度减弱。
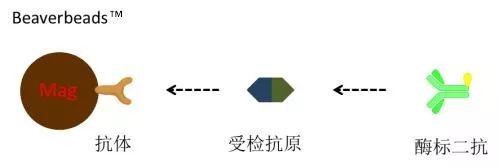
双抗夹心法(两步法) 双抗体夹心法是检测抗原最常用的方法,基本原理如下图所示。 双抗夹心法(一步法) 在一步法测定中,应注意钩状效应(hook effect),类同于沉淀反应中抗原过剩的后带现象。当标本中待测抗原浓度相当高时,过量抗原分别和固相抗体及酶标抗体结合,而不再形成夹心复合物,所得结果将低于实际含量。钩状效应严重时甚至可出现假阴性结果(如图, 双抗夹心法及双位点一步法。缺点:假阴性)